Hipotiroidismo
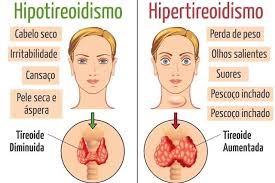
El hipotiroidismo es un síndrome clínico que se produce por una deficiencia de hormonas tiroideas, que a su vez da lugar a una lentificación generalizada de los procesos metabólicos. El hipotiroidismo en lactantes y niños da por resultado lentificación notoria del crecimiento y desarrollo, con consecuencias permanentes graves, incluso retraso mental, cuando ocurre durante la lactancia. El hipotiroidismo con inicio durante la adultez causa un decremento generalizado del metabolismo, con lentificación de la frecuencia cardiaca, consumo de oxígeno disminuido, y depósito de glucosaminoglucanos en espacios intercelulares, particularmente en la piel y el músculo, lo que en casos extremos produce el síndrome clínico de mixedema. Los síntomas y signos de hipotiroidismo en adultos son reversibles con terapia.
Etiología e incidencia
El hipotiroidismo puede clasificarse como: 1) primario (insuficiencia tiroidea) (con mucho el más frecuente); 2) secundario (debido a deficiencia de TSH hipofisaria), o 3) terciario (debido a deficiencia hipotalámica de TRH), o puede deberse a 4) resistencia periférica a la acción de hormonas tiroideas. El hipotiroidismo también puede clasificarse como con bocio o sin bocio, pero esta clasificación probablemente es insatisfactoria, porque la tiroiditis de Hashimoto (tiroiditis autoinmunitaria) puede producir hipotiroidismo con un bocio o sin éste.
La incidencia de las diversas causas de hipotiroidismo varía dependiendo de factores geográficos y ambientales, como ingestión de yoduro y de bociógenos en la dieta, las características genéticas de la población, y la distribución de la población por edades (pediátrica o adulta). La tiroiditis de Hashimoto es con mucho la causa más común de hipotiroidismo en el mundo desarrollado. En pacientes más jóvenes es más probable que se relacione con bocio; en pacientes de mayor edad, el proceso inmunitario puede destruir por completo la glándula, y el único rastro de la enfermedad son resultados persistentemente positivos en una prueba para anticuerpos contra TPO. De modo similar, la etapa terminal de la enfermedad de Graves puede ser hipotiroidismo, que ocurre de modo espontáneo o después de terapia destructiva con yodo radiactivo o tiroidectomía. Las glándulas tiroides afectadas por enfermedad autoinmunitaria son en particular susceptibles a ingestión excesiva de yoduro (p. ej., ingestión de tabletas de algas, en especial del género Laminaria, preparaciones para la tos que contienen yoduro o el fármaco antiarrítmico amiodarona), o administración intravenosa de medios de contraste radiográficos que contienen yoduro.
Las cantidades grandes de yoduro bloquean la síntesis de hormona tiroidea mediante el efecto de Wolff-Chaikoff, lo que produce hipotiroidismo inducido por yodo, con bocio, en el paciente con una glándula tiroides anormal; la glándula normal escapa al efecto de Wolff-Chaikoff o bloqueo por yoduro, pero por razones que no están claras la autoinmunidad hace a la glándula más sensible a los efectos inhibidores del yodo. Puede ocurrir hipotiroidismo durante la fase tardía de tiroiditis subaguda o de tiroiditis silenciosa; esto por lo general es transitorio, pero puede ser permanente, especialmente en la tiroiditis silenciosa, en la cual se observa hipotiroidismo permanente en alrededor de 25% de enfermos. La deficiencia de yodo no es una causa de hipotiroidismo en Estados Unidos, pero aún se observa en países en desarrollo, y es la causa más común de hipotiroidismo en todo el mundo. Ciertos fármacos pueden bloquear la síntesis de hormona y producir hipotiroidismo con bocio; en la actualidad, las causas farmacológicas más comunes de hipotiroidismo (que no son yoduro) son carbonato de litio, usado para el tratamiento de enfermedad bipolar, y amiodarona. La terapia crónica de hipertiroidismo con los fármacos antitiroideos PTU y metimazol tienen los mismos efectos.
El interferón alfa, usado para tratar hepatitis C y otras enfermedades, puede causar inmunidad alterada que puede dar por resultado hipotiroidismo debido a tiroiditis de Hashimoto. Los errores congénitos de la síntesis de hormona tiroidea, llamados dishormonogénesis tiroidea, se producen por deficiencias genéticas de enzimas necesarias para la biosíntesis de hormona. Estos efectos pueden ser completos, lo que da lugar a un síndrome de hipotiroidismo congénito grave (cretinismo) con bocio, o parciales, lo que suscita bocio con hipotiroidismo más leve. Se han reportado al menos cinco anormalidades biosintéticas separadas: 1) alteración del transporte de yodo; 2) peroxidasa tiroidea deficiente con oxidación alterada de yodo, y fracaso de la incorporación de yodo hacia la tiroglobulina; 3) acoplamiento alterado de tirosinas yodadas a triyodotironina o tetrayodotironina; 4) falta de yodotirosina desyodasa o deficiencia de la misma, de modo que el yodo no se conserva dentro de la glándula, y 5) producción excesiva de yodo proteína inactiva desde el punto de vista metabólico por la glándula tiroides. Esto último puede comprender síntesis alterada o anormal de tiroglobulina.
Las deficiencias hipofisarias e hipotalámicas como causas de hipotiroidismo son bastante raras, y por lo general se relacionan con otros síntomas y signos de insuficiencia hipofisaria.
Patogenia
La deficiencia de hormona tiroidea afecta a casi cualquier tejido del cuerpo, de modo que los síntomas son múltiples. Desde el punto de vista patológico, el dato más característico es la acumulación de glucosaminoglucanos, en su mayor parte de ácido hialurónico en tejidos intersticiales. La acumulación de esta sustancia hidrofílica y el aumento de la permeabilidad capilar a la albúmina explican el edema intersticial sin signo de Godete que es en particular evidente en la piel, el músculo cardiaco y el músculo estriado. La acumulación no se debe a síntesis excesiva de glucosaminoglucanos, sino a metabolismo disminuido de los mismos.
Presentaciones clínicas y datos
- Recién nacidos (cretinismo) El término “cretinismo” originalmente se aplicó a lactantes nacidos en áreas de deficiencia grave de yodo, con retraso mental, estatura corta, un aspecto abotagado característico de la cara y las manos y (con frecuencia) sordomudez y signos neurológicos de anormalidades de los tractos piramidal y extrapiramidal. En áreas de suficiencia de yodo, el hipotiroidismo neonatal típicamente se produce por fracaso del descenso de la tiroides durante el desarrollo embrionario desde su origen en la base de la lengua hasta su sitio
 habitual en la parte anterior baja del cuello, lo que da por resultado falta de glándula tiroides o glándula tiroides ectópica que funciona mal. La transferencia placentaria hacia el embrión de anticuerpos bloqueadores contra receptor de TSH desde una madre con tiroiditis de Hashimoto puede dar por resultado agenesia de la glándula tiroides y cretinismo atirótico, pero por lo general sólo causa hipotiroidismo transitorio. Los defectos hereditarios de la biosíntesis de hormona tiroidea también pueden causar hipotiroidismo y bocio neonatales. Otras causas posibles de hipotiroidismo neonatal son exposición a yoduros durante el embarazo, administración de fármacos antitiroideos a la madre, o administración inadvertida de yodo radiactivo para tirotoxicosis o cáncer tiroideo.
habitual en la parte anterior baja del cuello, lo que da por resultado falta de glándula tiroides o glándula tiroides ectópica que funciona mal. La transferencia placentaria hacia el embrión de anticuerpos bloqueadores contra receptor de TSH desde una madre con tiroiditis de Hashimoto puede dar por resultado agenesia de la glándula tiroides y cretinismo atirótico, pero por lo general sólo causa hipotiroidismo transitorio. Los defectos hereditarios de la biosíntesis de hormona tiroidea también pueden causar hipotiroidismo y bocio neonatales. Otras causas posibles de hipotiroidismo neonatal son exposición a yoduros durante el embarazo, administración de fármacos antitiroideos a la madre, o administración inadvertida de yodo radiactivo para tirotoxicosis o cáncer tiroideo.
Los signos de hipotiroidismo en recién nacidos son dificultad respiratoria, cianosis, ictericia, alimentación inadecuada, llanto ronco, hernia umbilical, y retraso notorio de la maduración ósea. La epífisis tibial proximal y la epífisis femoral distal están presentes en la mayoría de los lactantes a término con un peso corporal de más de 2 500 g.
La falta de estas epífisis sugiere fuertemente hipotiroidismo. La introducción de pruebas de detección sistemáticas de recién nacidos para TSH o T4 en el mundo desarrollado ha sido un importante logro de salud pública, porque el diagnóstico temprano puede prevenir retraso mental permanente. Una gota de sangre obtenida mediante punción del talón 24 a 48 h después del nacimiento se coloca sobre papel filtro y se envía a un laboratorio central. Una T4 sérica de menos de 6 μg/ dl o una TSH sérica de más de 25 mU/L es sugestiva de hipotiroidismo neonatal. A continuación el diagnóstico puede confirmarse al repetir las pruebas y al obtener evidencia radiográfica de edad ósea retardada. Nótese que los lactantes eutiroideos hijos de madres hipotiroideas que han recibido tratamiento insuficiente con levotiroxina durante el embarazo no son hipotiroideos, pero pueden tener potencial intelectual disminuido en etapas más avanzadas de la niñez, lo que recalca la importancia de mantener a la madre en un estado eutiroideo durante todo el embarazo.
- Niños y adolescentes El hipotiroidismo en niños y adolescentes se caracteriza por retraso del crecimiento y estatura baja, los signos y síntomas típicos de hipotiroidismo observados en adultos, y rendimiento escolar variable pero por lo general en declinación. Puede ocurrir pubertad precoz y quizás haya agrandamiento de la silla turca debido a hiperplasia de células tirotropas hipofisarias relacionada con producción aumentada de TSH.
- Adultos En adultos, los datos comunes de hipotiroidismo moderado a grave son fatigabilidad fácil; sensibilidad al frío; aumento de peso (por lo general <4.540 a 9.080 kg); estreñimiento; anormalidades menstruales, en especial menorragia, y calambres musculares.
Los datos físicos pueden incluir piel fría, áspera y reseca; cara y manos abotagadas, voz ronca y reflejos lentos. La conversión reducida de caroteno en vitamina A, y la concentración sanguínea aumentada de caroteno, pueden impartir un color amarillento a la piel. Sin embargo, muchos de los síntomas y signos, o todos, están disminuidos o no se observan en pacientes con grados más leves de insuficiencia tiroidea.
- Signos cardiovasculares. El hipotiroidismo se manifiesta por contracción ventricular alterada, bradicardia, y aumento de la resistencia periférica, lo que da lugar a gasto cardiaco disminuido. El electrocardiograma (ECG) puede revelar voltaje bajo de los complejos QRS y de las ondas P y T, con mejoría en respuesta a la terapia. Puede ocurrir agrandamiento cardiaco, debido en parte a edema intersticial, tumefacción miofibrilar inespecífica, y dilatación del ventrículo izquierdo, así como derrame pericárdico no importante desde el punto de vista hemodinámico.
El grado de derrame pericárdico puede determinarse fácilmente por medio de ecocardiografía. Aunque el gasto cardiaco está reducido, rara vez se notan insuficiencia cardiaca congestiva y edema pulmonar. Hay controversias respecto a si el hipotiroidismo induce arteriopatía coronaria, pero la enfermedad de arteria coronaria es más común en pacientes con hipotiroidismo, lo cual quizá se relaciona con cifras aumentadas de colesterol total, colesterol de LDL, y posiblemente otros factores aterogénicos no tradicionales, como la lipoproteína A y la homocisteína. En pacientes con angina de pecho, el hipotiroidismo puede proteger el corazón contra el estrés isquémico, y la terapia de reemplazo puede agravar la angina al aumentar el consumo miocárdico de oxígeno.
- Función pulmonar. En el adulto, el hipotiroidismo se caracteriza por respiraciones lentas y superficiales, y por respuestas ventilatorias alteradas a la hipercapnia o hipoxia. La insuficiencia respiratoria es un problema importante en pacientes con coma mixedematoso.
- Peristaltismo intestinal. El peristaltismo está notoriamente lentificado, lo que suscita estreñimiento crónico y en ocasiones impactación fecal o íleo grave.
- Función renal. La función renal está alterada, con decremento del índice de filtración glomerular y capacidad alterada para excretar una carga de agua. Esto predispone al paciente hipotiroideo a hiponatremia por intoxicación por agua si se administra agua libre excesiva.
- Anemia. Hay al menos cuatro mecanismos que pueden contribuir a la anemia en pacientes con hipotiroidismo: 1) síntesis de hemoglobina alterada como resultado de deficiencia de tiroxina;
2) deficiencia de hierro por aumento de la pérdida de dicho elemento con la menorragia, así como absorción intestinal alterada de hierro; 3) deficiencia de folato por alteración de la absorción intestinal de ácido fólico, y 4) anemia perniciosa, con anemia megaloblástica por deficiencia de vitamina B12. La anemia perniciosa a menudo forma parte de una agrupación de enfermedades autoinmunitarias, entre ellas hipotiroidismo debido a tiroiditis de Hashimoto o autoinmunitaria relacionada con autoanticuerpos contra la tiroides, anemia perniciosa vinculada con autoanticuerpos contra células parietales, diabetes mellitus relacionada con autoanticuerpos contra células de los islotes, e insuficiencia renal vinculada con autoanticuerpos contra las suprarrenales (síndrome de Schmidt). Estas enfermedades forman parte de lo que se ha denominado el síndrome de insuficiencia poliglandular.
- Sistema neuromuscular. Muchos pacientes se quejan de síntomas atribuibles al sistema neuromuscular, incluso calambres musculares intensos, parestesias y debilidad muscular.
- Sistema nervioso central. Los síntomas pueden incluir fatiga, letargo e incapacidad para concentrarse, crónicos. Los pacientes con hipotiroidismo por lo general están bastante plácidos pero pueden estar gravemente deprimidos o incluso en extremo agitados (locura mixedematosa).
- Sistema reproductor. El hipotiroidismo altera la conversión de precursores de estrógeno hacia estrógenos, lo que da por resultado secreción alterada de FSH y LH, y ciclos anovulatorios y esterilidad. Esto puede relacionarse con menorragia, que también puede deberse, en parte, a función plaquetaria alterada. Los varones pueden tener decremento de la libido y disfunción eréctil.
Diagnóstico
La combinación de FT4 sérica baja y TSH sérica alta es diagnóstica de hipotiroidismo primario. Las cifras séricas de T3 son variables y pueden estar dentro del rango normal. Generalmente, la FT4 sérica es normal o normal baja, y la TSH sérica está un poco alta, situación que se denomina hipotiroidismo subclínico. Esto representa la forma más leve de hipotiroidismo, y es una consecuencia de la relación de la retroacción muy sensible entre la tiroides y la hipófisis.
En estas circunstancias, un pequeño decremento de la producción de hormona tiroidea por la tiroides, en el cual la concentración sérica de T4 aún está dentro del rango normal, suscita una concentración sérica de pH que está alta, aunque por lo general es de menos de 10 mU/L. El hipotiroidismo subclínico por lo general se debe a tiroiditis de Hashimoto subyacente, que puede confirmarse por medio de la evaluación de los títulos de anticuerpos anti-TPO. En pacientes con hipotiroidismo secundario o central, la FT4 sérica estará baja, y la TSH sérica estará baja o será normal, más que estar alta.
El paciente puede estar tomando hormona tiroidea (T4 en tabletas) cuando se le atiende por vez primera. Una glándula tiroides palpable o agrandada, y un resultado positivo en la prueba para autoanticuerpos contra la tiroides sugerirían tiroiditis de Hashimoto subyacente, en cuyo caso debe continuarse la administración del medicamento. En ausencia de anticuerpos antitiroideos, y si la indicación para terapia es incierta, el medicamento se debe suspender durante seis semanas y deben cuantificarse la FT4 y la TSH. El periodo de seis semanas de suspensión es necesario debido a la vida media prolongada de la T4 (siete días), y para permitir que la glándula hipófisis se recupere después de un periodo prolongado de supresión. En individuos hipotiroideos, la TSH sérica se torna alta a las 5 a 6 semanas y la FT4 permanece subnormal, mientras que ambas son normales después de seis semanas en individuos eutiroideos.
El cuadro clínico de mixedema desarrollado por completo generalmente es bastante claro, pero los síntomas y signos de hipotiroidismo leve o subclínico pueden ser muy sutiles o nulos. Esto ha llevado a la recomendación por algunas organizaciones profesionales de que se emprendan pruebas para detectar hipotiroidismo, especialmente en grupos de alto riesgo, como las mujeres de edad avanzada en las cuales la prevalencia es alta (hasta 20% en mujeres >65 años de edad) y en embarazadas, en las cuales el hipotiroidismo no tratado puede causar resultados adversos en el niño. A veces, los pacientes con hipotiroidismo se presentan con características poco comunes: neurastenia con síntomas de calambres, parestesias y debilidad musculares; anemia resistente a tratamiento; alteraciones de la función reproductora, incluso esterilidad, pubertad retrasada o precoz, o menorragia; edema idiopático o derrames pleuropericárdicos; retraso del crecimiento; constipación, rinitis o ronquera crónica debido a edema de la mucosa nasal o de las cuerdas vocales, y depresión grave que progresa hacia inestabilidad emocional o incluso psicosis paranoide manifiesta. En ancianos, el hipotiroidismo puede estar presente con apatía y retraimiento, que a menudo se atribuyen a senilidad. En esos casos, la evaluación de la función tiroidea con mediciones de la FT4 y la TSH séricas confirma o excluye hipotiroidismo como un factor precipitante.
Complicaciones
- Coma mixedematoso El coma mixedematoso, una enfermedad en extremo rara, es la etapa terminal del hipotiroidismo no tratado. Se caracteriza por debilidad, estupor, hipotermia, hipoventilación, hipoglucemia e hiponatremia progresivos, y finalmente puede dar por resultado choque y muerte. Ocurre con mayor frecuencia durante el invierno en pacientes del sexo femenino de edad avanzada con enfermedad pulmonar y vascular subyacente, y la mortalidad puede ser de más de 50%.
El paciente (o un miembro de la familia si el paciente está comatoso) puede recordar enfermedad tiroidea previa, tratamiento con yodo radiactivo o radioterapia en el área del cuello, o tiroidectomía.
El interrogatorio médico revela inicio gradual de letargo que progresa hacia estupor o coma. El examen revela bradicardia e hipotermia notoria, con temperatura corporal tan baja como de 24°C. El paciente por lo general es una anciana obesa con piel amarillenta, voz ronca, lengua grande, pelo delgado, ojos abotagados, íleo y reflejos lentos. Puede haber signos de otras enfermedades, como neumonía, infarto de miocardio, trombosis cerebral o sangrado gastrointestinal.
Pueden ocurrir crisis convulsivas, episodios de sangrado, hipocalcemia o hipercalcemia. Los indicios de laboratorio respecto al diagnóstico de coma mixedematoso son suero lactescente, caroteno sérico alto, colesterol sérico alto, y aumento de la proteína en el líquido cefalorraquídeo. Es posible que haya derrame pleural, pericárdico o abdominal con contenido alto de proteína. Las pruebas séricas revelan una FT4 baja y TSH notoriamente alta. Los autoanticuerpos contra la tiroides por lo general son fuertemente positivos, e indican tiroiditis de Hashimoto subyacente. El ECG muestra bradicardia sinusal y voltaje bajo. Si no hay estudios de laboratorio inmediatamente disponibles, lo cual suele suceder, el diagnóstico debe ser clínico.
La fisiopatología del coma mixedematoso comprende tres características principales: 1) retención de CO2 e hipoxia; 2) desequilibrio de líquido y electrólitos, y 3) hipotermia. La retención de CO2 y la hipoxia probablemente se deben en gran parte a depresión notoria de las respuestas ventilatorias a la hipoxia y la hipercapnia, aunque también pueden contribuir factores como obesidad, insuficiencia cardiaca, íleo, inmovilización, neumonía, derrame pleural o peritoneal, depresión del sistema nervioso central, y músculos débiles del tórax. El deterioro del impulso ventilatorio a menudo es grave, y en pacientes en coma mixedematoso casi siempre se necesita respiración asistida. La terapia con hormona tiroidea en pacientes con mixedema corrige la hipotermia y mejora la respuesta ventilatoria a la hipoxia. La intoxicación por agua, debida a perfusión renal disminuida y deterioro de la depuración de agua libre, es la principal alteración de líquidos y electrólitos. Esto causa hiponatremia y se maneja mejor mediante restricción de agua libre. La hipotermia a menudo no se reconoce, porque el termómetro clínico común sólo marca hasta alrededor de 34°C; es necesario usar un termómetro que registre una escala más amplia para obtener lecturas exactas de la temperatura corporal. El recalentamiento activo del cuerpo está contraindicado, porque puede inducir vasodilatación y colapso vascular. Un aumento de la temperatura corporal es una indicación útil de la eficacia de la terapia con T4. Los trastornos que pueden precipitar coma mixedematoso son insuficiencia cardiaca, neumonía, o administración de fármacos sedantes o narcóticos a un paciente con hipotiroidismo grave. La insuficiencia suprarrenal puede ocurrir ocasionalmente en relación con coma mixedematoso, sea debido a deterioro funcional de la hipófisis o a insuficiencia suprarrenal autoinmunitaria concurrente (síndrome de Schmidt). Se recomienda terapia concomitante con glucocorticoide hasta que pueda documentarse función suprarrenal normal mediante análisis de laboratorio. Tiene importancia diferenciar entre coma mixedematoso debido a insuficiencia primaria de la glándula tiroides, y el debido a insuficiencia hipofisaria (hipotiroidismo central). En esta última situación, es esencial el reemplazo de glucocorticoide. Los indicios clínicos respecto a la presencia de enfermedad hipofisaria son: un antecedente de amenorrea o impotencia, vello púbico o axilar escaso, y colesterol sérico normal, y cifras séricas normales o bajas de TSH. La CT o MRI puede revelar una silla turca agrandada.
- Hipotiroidismo y enfermedad del corazón En el pasado, el tratamiento de pacientes con hipotiroidismo grave e insuficiencia cardiaca, en particular arteriopatía coronaria, era muy difícil, porque el reemplazo de levotiroxina a veces se relacionaba con exacerbación de angina, insuficiencia cardiaca o infarto de miocardio. Ahora que se dispone de bloqueadores beta-adrenérgicos, angioplastia coronaria e pacientes hipotiroideos con arteriopatía coronaria pueden tratarse primero médica o quirúrgicamente, y entonces toleran mejor la terapia de reemplazo de tiroxina.
- Hipotiroidismo y enfermedad neuropsiquiátrica El hipotiroidismo a menudo se relaciona con depresión, que puede ser bastante grave. Más rara vez, los pacientes con hipotiroidismo grave pueden presentar confusión, paranoia o incluso manía (locura mixedematosa).
La investigación de pacientes admitidos a servicios psiquiátricos, con FT4 y TSH séricas es una manera eficiente de identificar a estos pacientes, que suelen mostrar respuesta a la terapia con T4 sola o en combinación con agentes psicofarmacológicos. La eficacia de la terapia con T4 en pacientes hipotiroideos deprimidos ha dado lugar a la hipótesis de que la adición de T3 o T4 regímenes psicoterapéuticos para depresión quizá sea útil en pacientes sin enfermedad tiroidea demostrable, pero este concepto ha sido difícil de probar.
Tratamiento
- Tratamiento del hipotiroidismo El hipotiroidismo se trata con T4, que se encuentra disponible en forma pura y es estable y económica. Dado que la T4 se convierte en T3 en los tejidos periféricos, ambas hormonas quedan disponibles, aun cuando sólo se administre una. La tiroides desecada ahora se considera obsoleta porque contiene tanto T4 como T3, y la triyodotironina (al igual que la liotironina) es insatisfactoria debido a su absorción rápida, vida media breve, y efectos transitorios. La vida media de la T4 es de alrededor de siete días, de modo que sólo necesita administrarse una vez al día. Se absorbe bien, y la concentración en sangre se vigila con facilidad al verificar las concentraciones de FT4 y las cifras séricas de TSH. Las concentraciones de T4 y T3 son estables durante todo el día, aunque hay un incremento leve de las cifras de T4 libre varias horas después de que se toma la medicación.
- Dosificación de levotiroxina
Las dosis de reemplazo de T4 en adultos varía de 0.05 a 0.2 mg/día, con una media de alrededor de 0.125 mg/día. La dosis de T4 varía de acuerdo con la edad y el peso corporal del paciente. Debido al metabolismo de T4 más rápido, los lactantes y niños de corta edad requieren una dosis sorprendentemente alta de T4 en comparación con los adultos. En adultos, la dosis de reemplazo media de T4 es de aproximadamente 1.7 μg/kg/día. En adultos de edad avanzada, la dosis de reemplazo por lo general es más baja, de alrededor de 1.6 μg/kg/día. Para la supresión de TSH en pacientes después de tiroidectomía por cáncer tiroideo, la dosis promedio de T4 es de alrededor de 2.2 μg/kg/día. En la mayoría de los pacientes con hipotiroidismo, es posible empezar el tratamiento con el requerimiento de dosis estimado completo. Luego de 4 a 6 semanas, la dosis final se ajusta con base en la concentración sérica de TSH. El objetivo es normalizar la TSH sérica, lo cual típicamente es de 0.5 a 4 mU/L. En pacientes de edad avanzada o aquellos con enfermedad cardiaca subyacente, es mejor empezar con dosis bajas de T4 (p. ej., 0.025 mg al día), y aumentar la dosis a intervalos de 4 a 6 semanas con base en las mediciones de TSH sérica. Los estados de malabsorción, o la administración concurrente de productos de soya, antiácidos con hidróxido de aluminio, resinas de unión a ácidos biliares como la colestiramina y el colestipol, complementos de calcio, sucralfato, o compuestos de hierro, disminuyen la absorción de T4. En estos pacientes, la T4 debe administrarse antes del desayuno, cuando el estómago está vacío, y los otros compuestos deben tomarse 4 h más tarde. Otros fármacos, como el medicamento anticonvulsivo carbamazepina, pueden aumentar los requerimientos de hormona tiroidea al incrementar el metabolismo de T4. Los inhibidores de la bomba de protones, como el omeprazol, también pueden alterar la absorción de T4, posiblemente al disminuir el ácido gástrico, pero los datos al respecto son contradictorios. El reemplazo de estrógeno puede aumentar los requerimientos de T4 al incrementar la unión de T4 libre a la TBG, mientras que la terapia con andrógeno tiene el efecto opuesto. La T4 tiene una vida media suficientemente prolongada (siete días), de modo que si el paciente es incapaz de tomar medicamentos por vía oral durante algunos días, la omisión de la terapia con T4 no será perjudicial. Si un paciente hospitalizado se está manejando mediante terapia por vía parenteral sostenida, la dosis parenteral de T4 es de alrededor de 75 a 80% de la dosis por vía oral habitual.
- Tratamiento del coma mixedematoso El coma mixedematoso es una urgencia médica aguda y debe tratarse en la unidad de cuidado intensivo. Es necesario vigilar con regularidad los gases en sangre, y por lo general se requieren intubación y ventilación mecánica. Deben buscarse enfermedades relacionadas, como infecciones o insuficiencia cardiaca, y tratarlas de manera apropiada. Los líquidos por vía intravenosa deben administrarse con precaución, y se evitará el ingreso excesivo de agua libre. Dado que los pacientes con coma mixedematoso pueden absorber los fármacos de manera inadecuada, es indispensable administrar la T4 por vía intravenosa. Estos pacientes tienen disminución corporal total notoria de T4, y deben recibir una dosis de saturación inicial de 300 a 400 μg por vía intravenosa, seguidos por 80% de la dosis de reemplazo completa calculada, por vía intravenosa, a diario. Si después de algunos días la respuesta clínica ha sido subóptima, algunos expertos recomiendan añadir T3 por vía intravenosa al régimen a una dosis de 5 μg cada 6 h. Las pautas clínicas para mejoría son un aumento de la temperatura corporal y el regreso de la función cerebral y respiratoria normal. Es necesario considerar la posibilidad de insuficiencia suprarrenal concomitante (debida a enfermedad suprarrenal autoinmunitaria o insuficiencia hipofisaria), y excluirla con una prueba de estimulación con cosintropina. Entonces debe administrarse apoyo suprarrenal completo (p. ej., hemisuccinato de hidrocortisona, 100 mg por vía intravenosa), seguido por 50 mg por vía intravenosa cada 6 h, con disminución lenta y progresiva de la dosis en el transcurso de siete días. Puede no darse apoyo suprarrenal si el cortisol plasmático antes del tratamiento es de 20 μg/dl o más, o si los resultados de una prueba de estimulación con cosintropina están dentro de límites normales. Cuando se administra T4 por vía intravenosa en dosis grandes, hay un riesgo inherente de precipitar angina, insuficiencia cardiaca o arritmias en pacientes de edad avanzada con arteriopatía coronaria subyacente.
Durante cierto tiempo, la tasa de mortalidad por coma mixedematoso fue de alrededor de 80%. El pronóstico ha mejorado tremendamente como resultado de reconocimiento de la importancia de la respiración mecánica asistida y el uso de T4 por vía intravenosa. En la actualidad el resultado probablemente depende de qué tan bien pueden manejarse las comorbilidades subyacentes y las consecuencias del hipotiroidismo grave.
- Mixedema con cardiopatía
En pacientes de edad avanzada, en particular aquellos con enfermedad cardiovascular conocida, es prudente empezar el tratamiento poco a poco. La T4 se administra en una dosificación de 0.025 mg/día durante 2 a 4 semanas; se aumentan 0.025 mg cada 2 a 4 semanas hasta alcanzar una dosis diaria de 0.075 mg; esta dosis se continúa durante alrededor de seis semanas. A continuación se mide la TSH sérica y se ajusta la dosificación en consecuencia. Típicamente se requieren de 2 a 4 meses para que un paciente llegue a equilibrio con dosificación completa. En algunos enfermos, el corazón es muy sensible a la concentración de T4 circulante, y si aparece angina de pecho o arritmia cardiaca, es esencial reducir la dosis de T4 de inmediato.
Efectos adversos de la terapia con T4
No hay casos reportados de alergia a la T4 pura, aunque es posible que un paciente presente una alergia al colorante o a algún componente de la tableta. Los principales efectos tóxicos de la sobredosificación de T4 son síntomas y signos de hipertiroidismo. Las palpitaciones son el síntoma cardiaco tirotóxico más común, y pueden ocurrir arritmias, en particular taquicardia o fibrilación auricular paroxística. El insomnio, el temblor, la inquietud y el calor excesivo también pueden ser problemáticos. El simple hecho de omitir las dosis diarias de T4 durante tres días y después reducir la dosificación corregirá el problema.
La resorción ósea aumentada y la osteoporosis se han relacionado con hipertiroidismo de larga evolución, y aparecerán también en mujeres posmenopáusicas tratadas en exceso de manera crónica con T4. Esto puede evitarse mediante vigilancia regular y al mantener concentraciones séricas normales de TSH en pacientes que están recibiendo terapia de reemplazo a largo plazo. En sujetos que reciben terapia supresora de TSH para cáncer tiroideo, si la concentración sérica de FT4 se mantiene dentro del límite normal superior, incluso si la TSH está suprimida, los efectos adversos de la terapia con T4 sobre los huesos serán mínimos. Además, la administración concomitante de estrógeno o bifosfonatos a mujeres posmenopáusicas que están recibiendo terapia con T4 en dosis altas, minimiza la resorción ósea.
Evolución y pronóstico
La evolución del hipotiroidismo no tratado consiste en deterioro lento, lo que en potencia lleva finalmente a coma mixedematoso y muerte. Aun así, con tratamiento apropiado, el pronóstico a largo plazo es excelente. Como consecuencia de la vida media prolongada (siete días) de la T4, se requiere tiempo para establecer equilibrio en una dosis fija. Por lo tanto, tiene importancia vigilar la FT4 y la TSH séricas cada 4 a 6 semanas hasta que se alcance un equilibrio. A partir de entonces, la FT4 y la TSH pueden vigilarse una vez cada 6 a 12 meses. La dosis de T4 se aumenta alrededor de 50% en la mayoría de las mujeres durante el embarazo; los mayores incrementos de la dosificación se realizan en mujeres que tienen menor reserva tiroidea (esto es, en mujeres en quienes se ha practicado una tiroidectomía o que han recibido terapia con yodo radiactivo). Los pacientes de edad avanzada metabolizan la T4 más lentamente, y es probable que la dosis tenga que disminuirse de manera gradual con la edad.
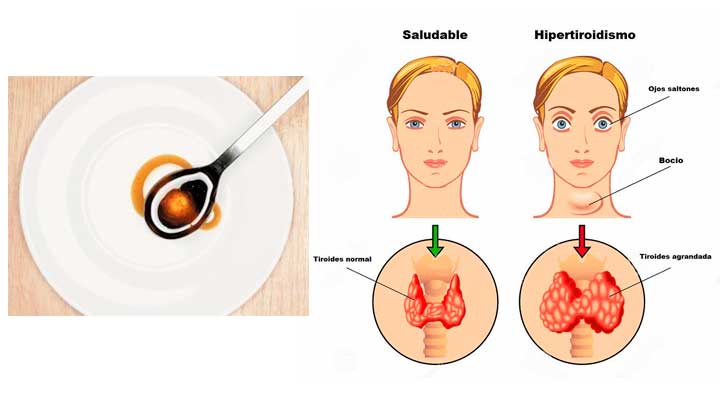
HIPERTIROIDISMO Y TIROTOXICOSIS
La tirotoxicosis es el síndrome clínico que se produce cuando los tejidos quedan expuestos a concentraciones altas de hormonas tiroideas circulantes. Da por resultado aceleración generalizada de procesos metabólicos. La tirotoxicosis casi siempre se debe a hiperactividad de la glándula tiroides, o hipertiroidismo. En ocasiones, la tirotoxicosis puede debe
rse a otras causas, como ingestión excesiva de hormona tiroidea o, muy rara vez, secreción excesiva de hormonas tiroideas a partir de un tumor ovárico (estruma ovárico).
- BOCIO TÓXICO DIFUSO
(ENFERMEDAD DE GRAVES)
La enfermedad de Graves es la forma más común de tirotoxicosis. Las mujeres quedan afectadas alrededor de cinco veces más comúnmente que los varones. La enfermedad puede ocurrir a cualquier edad, con una incidencia máxima en el grupo de 20 a 40 años. El síndrome consta de uno o más de los datos que siguen: 1) tirotoxicosis; 2) bocio; 3) oftalmopatía (exoftalmos), y 4) dermopatía (mixedema pretibial).
Etiología
La enfermedad de Graves en la actualidad se considera una enfermedad autoinmunitaria de origen desconocido. Hay una fuerte predisposición familiar, alrededor de 15% de los pacientes con enfermedad de Graves tiene un familiar cercano con el mismo trastorno, y aproximadamente 50% de los familiares de pacientes con enfermedad de Graves tiene autoanticuerpos circulantes contra la tiroides. Hay una concordancia mucho más alta de enfermedad de Graves en gemelos monocigóticos en comparación con la que se observa en gemelos dicigóticos, y puesto que la tasa de concordancia en gemelos monocigóticos es de mucho menos de 100%, debe haber factores ambientales que también participan. Los desencadenantes ambientales propuestos comprenden estrés, consumo de tabaco, infección y exposición a yodo. El estado posparto, que puede relacionarse con aumento de la función inmunitaria, también puede desencadenar enfermedad de Graves en mujeres susceptibles desde el punto de vista genético.
Patogenia
En la enfermedad de Graves, los linfocitos T quedan sensibilizados a antígenos dentro de la glándula tiroides, y estimulan linfocitos B para que sinteticen anticuerpos contra estos antígenos.
Un anticuerpo de ese tipo se dirige contra el receptor de TSH en la membrana celular tiroidea, lo que estimula el crecimiento de la glándula tiroides y la función de la misma. El anticuerpo se llama anticuerpo estimulante de la tiroides (TSAb), o inmunoglobulina estimulante de la tiroides (TSI). La presencia de este anticuerpo circulante guarda correlación positiva con enfermedad activa y con recaída de la enfermedad después de terapia con fármacos antitiroideos. Hay una predisposición genética subyacente, pero no está claro qué desencadena el comienzo inicial del hipertiroidismo. Algunos factores que pueden incitar la respuesta inmunitaria propia de la enfermedad de Graves son: 1) embarazo, en particular el periodo posparto; 2) el exceso de yoduro, particularmente en áreas geográficas en las cuales hay deficiencia de yoduro, donde la falta de este último puede mantener a raya una enfermedad de Graves latente; 3) interferón alfa, quizás al modificar la capacidad de respuesta inmunitaria; 4) infecciones virales o bacterianas, y 5) estrés psicológico. La patogenia de la oftalmopatía puede comprender linfocitos citotóxicos (células asesinas) y anticuerpos citotóxicos sensibilizados a un antígeno común como el receptor de TSH que se encuentra en fibroblastos orbitarios, músculo orbitario y tejido tiroideo. Las citocinas provenientes de estos linfocitos sensibilizados pueden causar activación y proliferación de fibroblastos y preadipocitos orbitarios, lo que da como resultado aumento de las cantidades de grasa y glucosaminoglucanos retroorbitarios, así como tumefacción de los músculos extraoculares, produciendo proptosis (protrusión) de los globos oculares y diplopía, así como enrojecimiento, congestión y edema conjuntival y periorbitario (oftalmopatía u orbitopatía relacionada con la tiroides). Por razones que no están claras, el tabaquismo es un potente factor de riesgo para la aparición de oftalmopatía relacionada con la tiroides. La patogenia de la dermopatía tiroidea (mixedema pretibial) y la rara inflamación subperióstica en las falanges de las manos y los pies (osteopatía o acropaquia tiroidea) también pueden comprender la estimulación de fibroblastos en estas ubicaciones por citocinas de linfocitos. Muchos síntomas de tirotoxicosis sugieren un estado de exceso de catecolamina, incluso taquicardia, temblor, sudoración, asinergia oculopalpebral y mirada fija, sin embargo, las concentraciones circulantes de adrenalina y noradrenalina son normales o bajas; así, en la enfermedad de Graves el cuerpo parece tener sensibilidad aumentada a las catecolaminas. Esto puede deberse en parte a incremento (mediado por hormona tiroidea) de receptores beta-adrenérgicos unidos a membrana en diversos tejidos.
Datos clínicos
- Síntomas y signos En individuos más jóvenes, las manifestaciones comunes comprenden palpitaciones, nerviosismo, fatigabilidad fácil, hipercinesia, diarrea, sudoración excesiva, intolerancia al calor, y preferencia por el frío. A menudo hay pérdida de peso notoria sin pérdida del apetito. Comúnmente ocurren agrandamiento de la tiroides, signos oculares de tirotoxicidad y taquicardia leve. La debilidad muscular y la pérdida de masa muscular pueden ser tan acentuadas que el paciente no puede levantarse de una silla sin ayuda. En niños hay crecimiento rápido con maduración ósea acelerada. En pacientes de más de 60 años de edad predominan las manifestaciones cardiovasculares y miopáticas, las molestias de presentación más comunes son palpitaciones, disnea de esfuerzo, temblor, nerviosismo y pérdida de peso.
Werner ha clasificado los signos oculares de la enfermedad de; esta clasificación es útil para describir la extensión de la afección ocular. Empero, no es útil para vigilar el proceso de la enfermedad, porque una clase no necesariamente progresa hacia la siguiente. La clase 1 comprende retracción de los párpados superiores relacionada con tirotoxicosis activa y por lo general se resuelve de manera espontánea cuando la tirotoxicosis se controla satisfactoriamente. La retracción de los párpados puede observarse en cualquier forma de tirotoxicosis, porque se debe a estimulación adrenérgica del párpado superior. Las clases 2 a 6 representan enfermedad infiltrativa verdadera que afecta los músculos y tejidos orbitarios, y son específicas para enfermedad de Graves. La clase 2 se caracteriza por afección de tejido blando con edema periorbitario, congestión o enrojecimiento, y edema de la conjuntiva (quemosis). La clase 3 consta de proptosis según se mide con el exoftalmómetro de Hertel; este instrumento consta de dos prismas con una escala montada en una varilla. Los prismas se colocan en los rebordes orbitarios laterales, y la distancia desde el reborde orbitario hasta la parte anterior de la córnea se mide en la escala. La clase 4 consta de afección de músculos extraoculares, que típicamente se debe a fibrosis y falta de relajación muscular, lo que limita la función del músculo antagonista. El recto inferior es el músculo más comúnmente afectado en el proceso infiltrativo. Al no relajarse normalmente, la limitación de la mirada hacia arriba es el signo más común en pacientes con afección de músculos oculares. El siguiente músculo más comúnmente afectado es el recto medial, lo que altera la mirada lateral. La clase 5 se caracteriza por afección corneal (queratitis) debida a incapacidad para cerrar los ojos por completo. La clase 6 es una pérdida de la visión por afección del nervio óptico, probablemente debido a isquemia del nervio por compresión de los músculos extraoculares agrandados circundantes. Como se mencionó, la oftalmopatía tiroidea se debe a infiltración de fibroblastos orbitarios y de los músculos extraoculares con linfocitos, y líquido de edema debido a una reacción inflamatoria. La órbita es un cono encerrado por hueso, y la tumefacción de los músculos extraoculares dentro de este espacio cerrado causa proptosis del globo y alteración del movimiento muscular, lo que da por resultado diplopía. El agrandamiento del músculo ocular puede demostrarse mediante ecografía o CT orbitaria, o MRI. Si bien sólo alrededor de una tercera parte de los pacientes tiene afección ocular en clínica, en más de 90% pueden detectarse músculos agrandados mediante estudios de imágenes. La dermopatía tiroidea consta de engrosamiento de la piel, en particular sobre la parte baja de la tibia, debido a acumulación de
glucosaminoglucanos. Es relativamente rara; ocurre en alrededor de 2 a 3% de los pacientes con enfermedad de Graves. Por lo general se relaciona con oftalmopatía importante y con un título sérico muy alto de TSAb. La piel está notoriamente engrosada, con una superficie en cáscara de naranja, y no puede tomarse entre los dedos. A veces la dermopatía afecta toda la pierna, y puede extenderse hasta los pies. Finalmente, la afección ósea (osteopatía o acropaquia tiroidea), con formación de hueso subperióstico e hinchazón, es en particular evidente en los huesos metacarpianos como dedos de las manos hipocráticos, este también es un dato relativamente raro. Un dato más común en la enfermedad de Graves es la separación entre las uñas y los lechos ungueales de las manos (onicólisis o uñas de Plummer), probablemente causado por crecimiento rápido de las uñas.
1. Datos de laboratorio
La combinación de una FT4 alta y TSH suprimida hace el diagnóstico de hipertiroidismo. Un 5% de los enfermos tiene concentración normal de FT4, pero alta de T3 sérica, una situación que se denomina tirotoxicosis por T3. Asimismo, la enfermedad de Graves muy leve puede dar por resultado concentraciones séricas de FT4 y T3 que están dentro del rango normal pero que están suficientemente altas como para llevar a supresión de la concentración sérica de TSH, una situación denominada hipertiroidismo subclínico. Si hay aumento tanto de la FT4 como de la TSH, y la RAIU también está alta, se considera la presencia de un tumor hipofisario secretor de TSH o síndromes de resistencia generalizada o hipofisario. Los pacientes muy graves pueden tener concentración sérica baja de TSH, pero también tienen cifras séricas bajas de FT4 y T3 (el llamado síndrome del eutiroideo enfermo). En la enfermedad llamada hipertiroxinemia disalbuminémica familiar, hay una albúmina anormal en el suero, que se une de preferencia a T4 pero no a T3. Esto da lugar a aumento de la T4 y de FT4I séricas, y a menudo de la T4 libre cuando se mide mediante ensayos de T4 libre análogos clínicos habituales, pero la T4 libre por lo general es normal mediante métodos de diálisis de equilibrio, al igual que la T3 y la TSH séricas. Es importante diferenciar entre este estado eutiroideo e hipertiroidismo verdadero. Además de la ausencia de datos clínicos de hipertiroidismo, una concentración sérica normal de T3 y normal de TSH excluye hipertiroidismo. Si hay signos oculares, el diagnóstico de enfermedad de Graves puede hacerse sin más análisis. En ausencia de signos oculares, y si el paciente es hipertiroideo con bocio o sin él, debe efectuarse una prueba de RAIU. Una captación alta es típica de enfermedad de Graves.
En contraste, se observa captación baja en pacientes con varias formas de hipertiroidismo que se resuelve de manera espontánea, como en la tiroiditis subaguda o la tiroiditis silenciosa también llamada tiroiditis posparto. También se encuentra captación baja de yodo radiactivo en pacientes que reciben una carga de yodo o que están en terapia con T4 o, rara vez, en asociación con estruma ovárico en el cual hay tejido tiroideo ectópico dentro de un teratoma ovárico. Los autoanticuerpos contra la tiroides contra tiroglobulina y TPO por lo general están presentes en el suero tanto en la enfermedad de Graves como en la tiroiditis silenciosa, una variante de la tiroiditis de Hashimoto, pero los antiTSH son relativamente específicos para la enfermedad de Graves. Esto puede ser una prueba diagnóstica útil en el paciente que se presenta con exoftalmos unilateral o bilateral sin signos obvios o manifestaciones de laboratorio de enfermedad de Graves (la llamada “enfermedad de Graves eutiroidea”). La gammagrafía con 123 I o con tecnecio es útil para evaluar el tamaño de la glándula, así como la presencia de nódulos calientes o fríos. La CT y la MRI de las órbitas revelan agrandamiento de los músculos extraoculares en la mayoría de los pacientes con enfermedad de Graves, incluso cuando no hay evidencia clínica de oftalmopatía. En pacientes con oftalmopatía clínica, el agrandamiento de los músculos orbitarios puede ser notorio.
Complicaciones
La crisis tirotóxica (tormenta tiroidea) es la exacerbación aguda de todos los síntomas y signos de tirotoxicosis; a menudo se presenta como un síndrome cuya gravedad puede poner en peligro la vida. En ocasiones, la tormenta tiroidea puede ser leve y presentarse simplemente como una reacción febril inexplicable después de intervención quirúrgica tiroidea en un paciente que se ha preparado de manera inadecuada. Más comúnmente, ocurre en una forma más grave después de una operación, terapia con yodo radiactivo o parto, en un paciente con tirotoxicosis controlada de manera insatisfactoria, o durante una enfermedad o trastorno grave y estresante, como diabetes no controlada, traumatismo, infección aguda, reacción grave a fármacos, o infarto de miocardio. Las manifestaciones clínicas de la tormenta tiroidea son hipermetabolismo notorio y respuesta adrenérgica excesiva. La fiebre varía de 38 a 41°C, y se relaciona con rubor y sudoración. Hay taquicardia notoria, a menudo con fibrilación auricular y presión del pulso alta; en ocasiones ocurre insuficiencia cardiaca. Los síntomas del sistema nervioso central son agitación, inquietud, delirio notorios y coma. Los síntomas gastrointestinales son náusea, vómito, diarrea e ictericia. Un resultado mortal se relaciona con insuficiencia cardiaca y choque. En una época se creyó que la tormenta tiroidea se debía a liberación o descarga repentina de T4 y T3 almacenadas, desde la glándula tirotóxica. Empero, estudios cuidadosos han revelado que las concentraciones séricas de T4 y T3 en pacientes con tormenta tiroidea no necesariamente son más altas que en pacientes tirotóxicos sin esta afección. No hay evidencia de que la tormenta tiroidea se deba a producción excesiva de T3. Asimismo, en la tirotoxicosis, el número de sitios de unión adrenérgicos para catecolaminas aumenta, de modo que los tejidos cardiaco y nervioso tienen aumento de la sensibilidad a catecolaminas circulantes. Además, hay unión disminuida a TBG con aumento adicional de la T3 y T4 libres. Una teoría es que en estas circunstancias, con sitios de unión aumentados disponibles para catecolaminas, una enfermedad, infección o estrés quirúrgico agudo desencadenan un torrente de catecolaminas que, en asociación con cifras altas de T4 y T3 libres, precipita el problema agudo. La característica diagnóstica clínica más notoria de la crisis tirotóxica es la hiperpirexia fuera de proporción con otros datos. Los datos de laboratorio son T4, FT4 y T3 séricas altas, así como TSH suprimida.
Tratamiento de la enfermedad de Graves
Aunque el síndrome de enfermedad de Graves depende de mecanismos autoinmunitarios, el manejo se ha dirigido en su mayor parte hacia el control del hipertiroidismo. Se dispone de tres métodos buenos: farmacoterapia antitiroidea; 2) intervención quirúrgica, y 3) terapia con yodo radiactivo.
- Terapia con fármacos antitiroideos Los medicamentos antitiroideos metimazol, carbimazol y PTU actúan al inhibir la yodación (mediada por TPO) de la tiroglobulina para formar T4 y T3 dentro de la glándula tiroides. El PTU, no así el metimazol, bloquea la conversión periférica de T4 en T3; no obstante, en general no se considera que este efecto tenga importancia clínica excepto posiblemente en sujetos con tirotoxicosis o tormenta tiroidea grave. El carbimazol, usado en el Reino Unido y partes de la Mancomunidad de Naciones, es un derivado del metimazol que se metaboliza con rapidez hacia metimazol. Además, cada uno de estos fármacos puede tener efectos inmunosupresores de los cuales puede depender la remisión de la enfermedad que algunos pacientes tienen después de 1 a 2 años de tratamiento. En general, la farmacoterapia antitiroidea como una terapia de primera línea es más útil en pacientes jóvenes con glándula pequeña y enfermedad leve. El fármaco se administra durante hasta 1 a 2 años, y después se disminuye de manera lenta y progresiva o se suspende para ver si se ha alcanzado una remisión. Las remisiones, que se definen como función tiroidea normal durante un año después de la suspensión del fármaco antitiroideo, ocurre en 20 a
50% de los pacientes, pero puede no durar toda la vida. Por lo general se inicia farmacoterapia antitiroidea con dosis más grandes. Cuando el paciente se hace eutiroideo desde el punto de vista bioquímico después de 4 a 12 semanas, puede lograrse terapia de mantenimiento con una dosis más baja. Debido al potencial de hepatotoxicidad grave y en potencia mortal con PTU, el metimazol es el mejor fármaco antitiroideo para la mayoría de los pacientes. El metimazol tiene una duración de acción más prolongada, y la dosificación diaria única lleva a mejoría del apego a las indicaciones. Un régimen típico empieza con una dosis de 10 a 20 mg de metimazol cada mañana durante
1 a 2 meses; estas dosis a continuación se reducirían a 5 a 10 mg cada mañana para terapia de mantenimiento. El PTU podría considerarse en pacientes con reacciones alérgicas leves al metimazol, y se prefiere en embarazadas durante el primer trimestre debido a raros efectos teratogénicos del metimazol en el feto. Un régimen de uso común consta de administrar PTU, 100 mg cada 8 h inicialmente, y después en 4 a 8 semanas, con reducción de la dosis a 50 a 200 mg 1 o 2 veces al día. Las pruebas de laboratorio más valiosas en la vigilancia temprana de la evolución de la terapia son la FT4 y T3 séricas. La concentración de TSH a menudo permanece suprimida durante muchas semanas o incluso meses; por ende, no es un índice fiable de la función tiroidea al principio del tratamiento. En un método de terapia alternativo se utiliza el concepto de un bloqueo total de la actividad tiroidea. Se trata al paciente con metimazol hasta que es eutiroideo (durante alrededor de 3 a 6 meses), pero en lugar de seguir disminuyendo paulatinamente la dosis de fármaco antitiroideo, en este punto se agrega T4 en una dosis de alrededor de 0.1 mg/día. El paciente a continuación sigue recibiendo la combinación de fármaco antitiroideo y T4 (0.1 mg/día) durante otros 12 a 24 meses. Al final de este tiempo, o cuando el tamaño de la glándula ha vuelto a lo normal, se suspenden los fármacos. Esta terapia combinada evita la aparición de hipotiroidismo debido a dosis excesivas de fármacos antitiroideos, pero la frecuencia de recaída es casi la misma que después de tratamiento con fármacos antitiroideos solos. Es más caro, porque se necesitan dos medicamentos, y puede haber mayor frecuencia de efectos secundarios. Por ende, esta estrategia no se recomienda para la mayoría de los pacientes.
- Duración de la terapia y otros factores relacionados con remisiones.
La duración de la terapia con fármacos antitiroideos en la enfermedad de Graves por lo general es de 12 a 24 meses; algunos pacientes prefieren recibir tratamiento, si es necesario, durante periodos prolongados (p. ej., decenios), pero esto no es típico. Una remisión sostenida es más probable en las circunstancias que siguen: 1) si la glándula tiroides vuelve al tamaño normal; 2) si la enfermedad puede controlarse con una dosis relativamente pequeña de fármacos antitiroideos, y 3) si los TSAb ya no son detectables en el suero al final del periodo de terapia.
- Reacciones a fármacos antitiroideos. Las reacciones alérgicas a medicamentos antitiroideos pueden ser menores, en especial un exantema (alrededor de 5% de los pacientes) o mayores, en particular agranulocitosis (aproximadamente 0.5% de los pacientes). El exantema a menudo puede manejarse al administrar antihistamínicos y, a menos que sea grave, no es una indicación para suspender la medicación. La agranulocitosis requiere cese inmediato de la farmacoterapia antitiroidea, institución de terapia con antibióticos apropiada, y cambio hacia una terapia alternativa, por lo general yodo radiactivo. La agranulocitosis generalmente es anunciada por faringoamigdalitis y fiebre graves. Así, deben darse instrucciones a todos los pacientes que están recibiendo fármacos antitiroideos de que si aparece faringoamigdalitis o fiebre, suspendan el medicamento, se pongan en contacto con su médico, y obtengan un recuento de leucocitos con diferencial. Si el recuento leucocítico es normal, puede reanudarse la administración del fármaco antitiroideo. La ictericia colestásica con metimazol, la toxicidad hepatocelular y la vasculitis con PTU, y la artritis aguda con uno u otro fármaco, son efectos secundarios graves pero raros que también requieren cese de la farmacoterapia. Como se mencionó, la gravedad de la hepatotoxicidad por PTU ha llevado a la advertencia emitida por la FDA de que el PTU sólo debe usarse en circunstancias especiales: en pacientes alérgicos al metimazol, que no son idóneos para la terapia con yodo radiactivo o intervención quirúrgica, y durante el primer trimestre del embarazo. El
PTU también puede preferirse en pacientes con tormenta tiroidea, en los cuales la inhibición de la conversión de T4 en T3 puede ser importante en clínica.
- Terapia con yodo radiactivo En Estados Unidos, el yoduro de sodio 131I es el tratamiento preferido para la mayoría de los pacientes de más de 21 años de edad. En muchos enfermos sin cardiopatía subyacente, el yodo radiactivo puede administrarse inmediatamente en una dosificación de 80 a 200 μCi/g de peso tiroideo estimado con base en el examen físico. Después de la administración de yodo radiactivo, que típicamente se administra por vía oral como una cápsula única, en la glándula disminuirá de tamaño, y el paciente por lo general se hará eutiroideo en el transcurso de un periodo de 2 a 6 meses. En pacientes ancianos y en aquellos con cardiopatía subyacente u otros problemas médicos, tirotoxicosis grave, o glándula grande (>100 g), es deseable alcanzar un estado eutiroideo antes de la terapia con 131 I, porque puede haber exacerbaciones ocasionales de la función tiroidea durante las semanas que siguen a la terapia con yodo radiactivo. Para ese propósito, por lo general se trata a los pacientes con metimazol hasta que son eutiroideos; entonces se suspende la medicación durante 3 a 7 días, y se administra la terapia con yodo radiactivo. El tratamiento previo con metimazol (o PTU) se ha relacionado con eficacia disminuida de la terapia con yodo radiactivo, lo que puede superarse con un aumento modesto de la dosis de este último. El hipotiroidismo es la complicación casi inevitable de la terapia con yodo radiactivo; aparece finalmente en más de 80% de los enfermos que recibieron tratamiento suficiente. El hipotiroidismo por lo general ocurre durante los primeros 6 a 12 meses después de la terapia, y es la mejor garantía de que no habrá una recurrencia de hipertiroidismo. Las concentraciones séricas de FT4 y TSH deben vigilarse cada 6 a 8 semanas, y cuando aparece hipotiroidismo se instituye terapia de reemplazo expedita con T4, 0.05 a 0.2 mg al día. Estudios de seguimiento a largo plazo han mostrado que la terapia con yodo radiactivo no causa esterilidad, defectos congénitos, ni cáncer en etapas más avanzadas de la vida. La enfermedad ocular de Graves grave es una contraindicación relativa para terapia con yodo radiactivo; en varios estudios prospectivos se ha mostrado que el yodo radiactivo puede exacerbar los problemas oculares cuando son graves en la basal. Los pacientes con hipertiroidismo subyacente grave y aquellos que fuman cigarrillos muestran propensión particular a una exacerbación después de tratamiento con yodo radiactivo. Empero, el empeoramiento potencial puede evitarse mediante la administración de prednisona, 30 a 60 mg al día durante 1 a 2 meses después del tratamiento con yodo radiactivo. La prednisona típicamente se usa en pacientes con enfermedad ocular de Graves moderada a grave, especialmente en los que fuman cigarrillos.
El hipotiroidismo también puede ocurrir como un suceso tardío después de un periodo de farmacoterapia antitiroidea más temprana para enfermedad de Graves; en esos pacientes, la enfermedad de Graves consumida probablemente es el resultado final de destrucción autoinmunitaria de la tiroides. En consecuencia, todos los pacientes con enfermedad de Graves que no se han hecho hipotiroideos requieren vigilancia de por vida a fin de asegurarse de que permanezcan eutiroideos.
- Tratamiento quirúrgico La tiroidectomía total o casi total es el mejor tratamiento para pacientes con glándula muy grande o bocio multinodular, para aquellos con un nódulo tiroideo sospechoso o maligno concomitante, para enfermos que son alérgicos a los fármacos antitiroideos o que no se apegan a las indicaciones de los mismos, para pacientes que no aceptan el tratamiento con yodo radiactivo, y para embarazadas con enfermedad de Graves grave que son alérgicas a los fármacos antitiroideos o que presentan reacciones a los mismos. Se prepara al paciente con fármacos antitiroideos hasta que es eutiroideo (alrededor de seis semanas). Además, empezando dos semanas antes del día de la operación, se puede dar al paciente solución saturada de yoduro de potasio, cinco gotas dos veces al día. Se cree que este régimen disminuye la vascularidad de la glándula y, así, aminora la pérdida de sangre intraoperatoria. Se requiere un cirujano experimentado, y se recomienda tiroidectomía total, porque si se deja demasiado tejido tiroideo la enfermedad puede recurrir. El hipoparatiroidismo y la lesión del nervio laríngeo recurrente ocurren como complicaciones de la operación en alrededor de 1% de los casos, con índices más bajos en manos de cirujanos de alto volumen.
- Otras medidas médicas Durante la fase aguda de la tirotoxicosis, los bloqueadores β-adrenérgicos son en extremo útiles. El propranolol, 10 a 40 mg cada 6 h, o los beta-bloqueadores de acción más prolongada, como el Inderal LA, nadolol, atenolol o metoprolol, controlan muchos síntomas adrenérgicos, taquicardia, hipertensión y fibrilación auricular. El fármaco se suspende de manera gradual a medida que las concentraciones séricas de FT4 y T3 vuelven a lo normal. Tanto la nutrición como el reposo suficientes son esenciales. Se ha mostrado que los colorantes colecistográficos por vía oral, ipodato de sodio y ácido iopanoico (no disponibles en Estados Unidos), inhiben tanto la síntesis de hormona tiroidea como la liberación de la misma, así como la conversión periférica de T4 en T3. En una dosificación de 1 g al día, estos fármacos pueden ayudar a restituir con rapidez el estado eutiroideo en pacientes muy graves. Dejan la glándula saturada con yoduro, de modo que no deben usarse inmediatamente antes de terapia con 131 I. La colestiramina, 4 g por vía oral tres veces al día, disminuye la T4 sérica al unirse a la misma en el intestino, y puede ser útil en pacientes gravemente hipertiroideos.
Elección de la terapia
La elección de la terapia varía con la naturaleza y la gravedad de la enfermedad y con las costumbres prevalentes; por ejemplo, en Estados Unidos, la terapia con yodo radiactivo ha sido el tratamiento preferido para el paciente promedio, mientras que en Europa y Asia se prefiere la farmacoterapia antitiroidea primaria. En general, los fármacos antitiroideos son una terapia inicial razonable para niños y adolescentes, y en adultos con enfermedad leve y bocios pequeños. En todos los otros pacientes el yodo radiactivo es el mejor tratamiento. En la actualidad, la participación de la intervención quirúrgica se limita a pacientes que no se apegan a las indicaciones y que rehúsan el yodo radiactivo, pacientes con un bocio grande, y otras circunstancias poco comunes antes mencionadas.
Tratamiento de complicaciones
- Crisis tirotóxica La crisis tirotóxica (tormenta tiroidea) requiere manejo vigoroso. El propranolol, 1 a 2 mg administrados por vía intravenosa lenta cada 5 a 10 min, para un total de 10 mg, o 40 a 80 mg cada 6 h por vía oral, es útil para controlar arritmias. Las dosis grandes de propranolol también tienen la capacidad para bloquear la conversión de T4 en T3. El esmolol, un beta-bloqueador de acción muy rápida, se administra a una dosis de 250 a 500 mg/kg/min como una dosis de saturación, seguida por 50 μg/kg/min con vigilancia cardiaca. Cuando hay insuficiencia cardiaca o asma y arritmias, graves, en las cuales pueden estar contraindicados los β-bloqueadores, la administración por vía intravenosa de verapamilo en una dosis de 5 a 10 mg, con precaución, puede ser eficaz. La administración de PTU, 250 mg cada 6 h, bloquea la síntesis de hormona. En la tormenta tiroidea, el PTU puede ser preferible al metimazol porque el PTU bloquea la conversión de T4 en T3. Si el paciente es incapaz de tomar medicamentos por vía oral, puede administrarse metimazol, en una dosis de 60 mg cada 24 h o PTU, 400 mg cada 6 h, mediante supositorio rectal o enema. Después de la administración de un antitiroideo, la liberación de hormona se retrasa mediante la administración por vía oral de una solución saturada de yoduro de potasio, 10 gotas dos veces al día. Los agentes colecistográficos por vía oral, ipodato de sodio o el ácido iopanoico, proporcionan una fuente de yodo y en potencia bloquean la conversión de T4 en T3, pero estos fármacos en la actualidad no están disponibles en Estados Unidos. Por lo general se recomienda la administración de hemisuccinato de hidrocortisona, o su equivalente, 50 mg por vía intravenosa cada 6 h, pero su papel en el manejo de tormenta tiroidea es incierto. La terapia de sostén comprende una frazada enfriadora y acetaminofeno para ayudar a controlar la fiebre. La aspirina está contraindicada debido a su tendencia a unirse a la TBG y desplazar la T4, lo que hace que haya más T4 disponible en el estado libre. El apoyo con líquidos, electrólitos y nutricional apropiado es importante. Para sedación, el fenobarbital puede ser útil porque acelera el metabolismo periférico y la desactivación de T4 y T3. El oxígeno, los diuréticos y la digoxina están indicados para insuficiencia cardiaca, o para fibrilación auricular, o para ambas; por último, es esencial tratar el proceso morboso subyacente que pueda haber precipitado la exacerbación aguda. Como una medida extrema (que rara vez se necesita) para controlar crisis tirotóxica, puede usarse plasmaféresis o diálisis peritoneal para eliminar las concentraciones altas de hormonas tiroideas libres circulantes.
- Oftalmopatía Para enfermedad leve, mantener la cabeza del paciente elevada por la noche, y la administración de diuréticos, puede ayudar a disminuir el edema periorbitario. La prednisona iniciada inmediatamente después de administración de yodo radiactivo, en una dosis de 30 a 60 mg/día, con reducción de la dosis 10 mg cada dos semanas, protege contra exacerbación de oftalmopatía después de terapia con 131I. El manejo de la oftalmopatía grave debida a enfermedad de Graves comprende cooperación estrecha entre el endocrinólogo y el oftalmólogo. Para reacciones inflamatorias agudas graves, suele ser eficaz un periodo de terapia breve con corticosteroide en dosis altas (p. ej., prednisona, 100 mg al día por vía oral en dosis divididas durante 7 a 14 días, y después cada dos días en una dosificación que se disminuye de manera gradual durante 6 a 12 semanas). De manera alternativa, puede usarse terapia intermitente (en “pulsos”) con metilprednisolona por vía intravenosa en dosis altas. Si la terapia con corticosteroide es ineficaz, o si hay recurrencia después de que se disminuye de forma paulatina el fármaco, puede ser útil la terapia con rayos X del área retrobulbar. La dosis por lo general es de 2 000 cGy en 10 fracciones administradas durante un periodo de dos semanas. Es necesario proteger el cristalino y las estructuras de la cámara anterior. En casos graves en los cuales la visión está amenazada, puede usarse descompresión orbitaria. Una operación comprende una vía de acceso transantral a través del seno maxilar, con extirpación del piso y las paredes laterales de la órbita. En la vía de acceso anterior alternativa se entra a la órbita bajo el globo ocular, y se extirpan partes del piso y las paredes de la órbita. Ambos métodos son eficaces, y el exoftalmos puede reducirse 5 a 7 mm en cada ojo mediante estas técnicas. Después de que el proceso agudo ha disminuido, el paciente a menudo queda con visión doble o anormalidades del párpado debido a fibrosis y contractura musculares o a la posición posoperatoria del globo ocular. Estos problemas pueden corregirse mediante intervención quirúrgica estética de los párpados o intervención quirúrgica de los músculos oculares.
- Tirotoxicosis y embarazo La tirotoxicosis durante el embarazo plantea un problema especial; es poco común y afecta a aproximadamente 0.1% de los embarazos. Tiene importancia recordar que la concentración sérica de TSH puede ser subnormal al final del primer trimestre en hasta 20% de las mujeres normales. Esto se debe a los efectos de la hCG sérica, cuyas cifras normalmente alcanzan un máximo al final del primer trimestre; la hCG activa el receptor de TSH. Este es un fenómeno transitorio, y es fisiológico, no patológico. La hiperemesis gravídica puede causar hipertiroidismo leve (la llamada tirotoxicosis gestacional ), que probablemente se debe a concentración sérica en extremo alta de hCG, presente en esta afección, que estimula el receptor de TSH. Sin embargo, no está indicado ningún tratamiento, porque el estado hipertiroideo se resuelve cuando lo hace la hiperemesis, por lo general hacia mediados de la gestación. En embarazadas con enfermedad de Graves, se trata a la paciente con fármacos antitiroideos durante la mayor parte del embarazo; la decisión respecto al manejo a largo plazo se pospone hasta después del parto. El yodo radiactivo está absolutamente contraindicado porque cruza la placenta libremente y puede lesionar la tiroides fetal. La dosificación de fármacos antitiroideos debe mantenerse al mínimo necesario para controlar los síntomas, porque tanto el PTU como el metimazol cruzan la placenta y pueden afectar la función de la glándula tiroides fetal. El PTU se prefiere sobre el metimazol porque este último tiene efectos teratogénicos raros (aplasia cutis y embriopatía por metimazol [atresia de las coanas, fístulas traqueoesofágicas y otros defectos]). Las recomendaciones actuales son limitar el uso de PTU al primer trimestre, y después cambiar a metimazol. Empero, puede usarse este último cuando hay alergia al PTU o respuesta clínica inadecuada al mismo. La enfermedad debe controlarse mediante dosis iniciales de PTU de 250 mg/día (en dosis divididas) o menos, y dosis de sostén de 25 a 100 mg/día, la probabilidad de hipotiroidismo fetal es en extremo baja. El FT4I o la FT4 deben mantenerse dentro del límite normal superior para mujeres no embarazadas mediante reducción apropiada de la dosificación del fármaco antitiroideo. En una minoría importante de pacientes, el fármaco se puede suspender durante la parte final del embarazo debido a desaparición espontánea de TSAb. Es necesario medir la concentración sérica de TSAb durante el tercer trimestre; los títulos altos pueden relacionarse con enfermedad de Graves neonatal. El amamantamiento es posible con uno u otro fármaco antitiroideo, porque las cifras bajas que se encuentran en la leche materna no afectan la función tiroidea en el recién nacido. La enfermedad de Graves puede ocurrir en el recién nacido (enfermedad de Graves neonatal) debido a paso transplacentario de TSAb. Si bien la mayoría de los lactantes con este síndrome raro son hijos de madres con enfermedad de Graves activa, en ocasiones puede ocurrir en lactantes hijos de madres hipotiroideas que en el pasado han recibido tratamiento con yodo radiactivo para enfermedad de Graves, pero que aún retienen TSAb circulantes. La enfermedad puede no ser evidente en el momento del nacimiento, porque los fármacos antitiroideos que se usan para tratar a la madre pueden cruzar la placenta y afectar también la tiroides del lactante. El niño nace pequeño, con músculos débiles, taquicardia, fiebre y a menudo con sufrimiento o ictericia neonatal. El examen revela una glándula tiroides agrandada y en ocasiones ojos abotagados y prominentes. La frecuencia cardiaca es rápida, la temperatura está alta, y puede sobrevenir insuficiencia cardiaca.
Los estudios de laboratorio revelan FT4I y o FT4 alta, aumento notorio de T3, y por lo general TSH baja, en contraste con los lactantes normales, que tienen TSH alta en el momento del nacimiento. La edad ósea puede estar acelerada; por lo general se encuentran TSAb en el suero tanto del lactante como de la madre. Se cree que la patogenia de este síndrome comprende transferencia transplacentaria de TSAb desde la madre hacia el feto, con aparición subsiguiente de tirotoxicosis. La enfermedad es autolimitada y disminuye durante un periodo de 4 a 12 semanas, lo cual coincide con el descenso de la concentración sérica de TSAb en el niño. La terapia para el lactante comprende PTU en una dosis de 5 a 10 mg/kg/día (en dosis divididas a intervalos de 8 h); solución de Lugol, una gota (8 mg de yoduro de potasio) cada 8 h, y propranolol, 2 mg/kg/día en dosis divididas. Además, están indicada nutrición adecuada, antibióticos para infección si la hay, sedantes si es necesario, y terapia de sostén. Si el niño tiene tirotoxicidad acentuada, la terapia con corticosteroide (prednisona, 2 mg/kg/día) bloquea parcialmente la conversión de T4 en T3, y puede ser útil durante la fase aguda. Los medicamentos anteriores se reducen de manera gradual a medida que el niño mejora, y por lo general pueden suspenderse hacia las 6 a 12 semanas. Los sueros maternos también pueden contener TSAb que funcionan como anticuerpos bloqueadores que pueden cruzar la placenta y producir hipotiroidismo transitorio en el lactante. Quizá sea necesario tratar esta afección mediante complementos de T4 durante un tiempo breve.
CÁNCER DE TIROIDES.
– Patología frecuente 1/1000000, desde poco hasta muy agresivo.
– Problemas fundamentales que plantean para tomar las decisiones: Difícil diagnostico,
Edad, Tipo histológico sospechado, Tamaño del tumor, Invasión linfática, Factores que modifican el pronóstico.
– Tipo histológico: Papilar, casi benigna, Folicular, Mixto papilar y folicular, Medular
Anaplasico: el mas agresivo de todos, Linfoma. Esto ha cambiado con los nuevos tratamientos de quimioterapia y radioterapia.
– Edad: A mas edad mas mortalidad. Adulto joven: 50% nódulos son malignos pero con buena evolución. Edad mayor de 45 años aumenta mucho la mortalidad.
– Tamaño y extensión linfática: < 1.5 cm> , sin invasión linfática suelen ser benignos. Y si hay Afectación linfática: empeora el pronostico.
EN UN ESTUDIO ANTEROPOSTERIOR:
Adenocarcinoma:
Cáncer papilar:
El mas benigno y ademas el mas frecuente (50-80%), es un tumor bien diferenciado, mas frecuente en mujeres a edad joven (20-40), es el mas silente clínicamente ( esto no están cierto porque el folicular que es un poco mas agresivo también es muy silente). Es un tumor pequeño, menor de 1 cm, pero que puede ser multicentrico, esto nos puede obligar a resecar el tiroides contralateral (pensamos que el otro lado puede tener un microcarcinoma).
Variante: papilarfolicular, mezcla de elementos celulares Es un tumor bien diferenciado, presenta psamomas o áreas de calcificación, característico de este tipo. Hay afectación linfática subclínica, microafectación en el 50% de los casos, estos ganglios no serán palpables, esto quiere decir que hay que hacer biopsia de los ganglios linfáticos para ver si hay afectación.
Folicular:
Predominio en zonas con déficit de yodo, mujeres jóvenes (2:4), escasa clínica. Es un tumor algo mas grande, es encapsulado. La diferencia mas importante con respecto al papilar, es que este no tiene tanta tendencia a infiltrar los linfáticos (10%). Enfocamos la tiroidectomia, pero no se busca con tanto ímpetu los ganglios, solo el primer ganglio , pero debemos de tener en cuenta que suele dar con mas frecuencia metástasis a distancia ( óseas y pulmonares). ( al contrario que el papilar que suele dar mas metástasis linfáticas y recidivas locales cuando son mas agresivos, el folicular es mas hematógeno, metástasis a distancia). Es un tumor muy vascularizado, encapsulado y funcionante, esto es bueno porque podemos tratar las metástasis a distancia con yodo radiactivo. Constituido por folículos que invaden el parénquima. Es una variedad que aumento mucho tras la catástrofe de Chernobil, en niños, con la variedad solida folicular, con una serie de alteraciones en la rotura del ADN e inversión del cromosoma 10, por lo que es un efecto carcinogenico que afecta mas a niños. La radiación por tanto aumenta el riesgo de tumor tiroideo en una proporción mayor en niños.
Anáplasico:
Poco frecuente 10%, en mujeres a edad avanzada, en zonas de bocio endémico, en estos grandes bocios se desarrolla a la larga un indiferenciacion celular que da el carcinoma anáplasico. Es un tumor no funcionante, con células indiferenciadas, capacidad de crecimiento muy elevada, infiltra capsula, linfáticos, tráquea y músculos del cuello, por lo que por su agresividad local da síndrome asfíctico y muerte en cuestión de meses. Suele tener metástasis linfáticos. Podemos tener incluso ulceraciones cutáneas.
Carcinoma de células de Hürtle:
Puede ser un adenoma o carcinoma que se diferencia según el tipo de células, es poco
frecuente. En ocasiones se da con una tiroiditis de Hashimoto. La diferencia entre adenoma y carcinoma depende de la histología y del comportamiento, este es un carcinoma donde hay que hacer tiroidectomia y linfadenectomia, porque puede tener un comportamiento muy agresivo.
Epidermoide: Muy poco frecuente, Medular: 3-10%, Tumor de celular parafoliculares. Linfomas y sarcomas: muy raros.
ESTUDIO CLINICO Y DIAGNOSTICO:
Sintomatología: – Prácticamente nula, en ocasiones se da en enfermos con hipertiroidismo, pero no es muy frecuente. Lo canceres de tiroides se diagnostican porque tienen nódulos no por hipertiroidismo. En casos de hipotiroidismo podemos encontrar cáncer de tiroides, pero no esta en relación con la función.
– Por lo que no hay relación con cuadros distiroideos
– Lo que vemos es una tumoración, no hay expresividad en técnicas de laboratorio
– Se diagnostica con ECO y PAAF.
Pero tener en cuenta:
– Edad y sexo del paciente ( nódulo en joven , sospechar malignidad), es mas frecuente en la mujer, pero un nódulo en el hombre tiene mayor probabilidad de cáncer.
– Historia de radiación previa
– Tumor solido o quístico
Evaluación diagnostica:
– Exploración: tamaño, consistencia, adherencia a piel o ECM, piel( le pedimos que degluta para ver si se mueve la glandula- duro, que no se moviliza, aumentado de
tamaño, pensaremos en tumor)
– Cadenas ganglionares , cuando palpamos adenopatías, tendremos mas sospecha de
que se trate de un tumor. Salvo tiroiditis tipo hashimoto, no hay adenopatías.
– Exploración general del enfermos: no aporta datos de interés.
– ECO: fácil de realizar, no es agresivo. Nos aporta densidad, limites, afectación ganglionar, nos da la heterogeniedad dentro del tumor (solido, liquido, calcificaiones o psamomas ( papilar)…), nos permite ademas hacer una PAAF.
– Eco doppler: con esto podemos ver la vascularización, que a mas intensa mas
probabilidad e folicular.
– Gammagrafía tiroidea: hoy día se hace menos, con los eco de última generación se ven
muy bien las características de las lesiones, y tenemos ecografistas especialistas y que
hacen buenas punciones. – TAC tiroideo: no se usa como diagnóstico para ver que tipo histológico es, solo nos sirve para ver si hay infiltración fuera de la glándula: adenopatías o lesiones a distancia
– Estudio de extensión: Rx torax, Gammagrafía ósea
TRATAMIENTO: En los tumores diferenciados: nodulectomía o hemitiroidectomía puesto que son benignos en su evolución ( tumores menores de 2 cm, pacientes menores de 40 años) , las guías clínicas modernas están diciendo que lo mejor es hacer tiroidectomia. Este cambio se debe a que el entrenamiento quirúrgico disminuye la morbimortalidad de la tiroidectomia, antes se temían los problemas de hipoparatiroidismo por llevarse la paratiroides, lesiones del recurrente. Tiroidectomia total o subtotal, esto da también ventaja para hacer los rastreos de metástasis postquirurgicas, porque lo que queda de glándula captarían el contraste.
También con la tiroidectomia total o subtotal: Evitamos las recidivas contralaterales, – Tendencia a trasformación anaplásica en anciano, No evita la necesidad de hormonoterapia ( esto es algo imprevisible, con hemitiroidectomia no precisamos en ocasiones de hormonoterapia, pero otros si, por lo que siempre debemos de hacer control analitico).
– Si hay que tratar con I131 (mtt): menor dosis, si hay remanaente tiroideo va a captar
todo el yodo, por lo que el tratamiento será menos eficaz.
– Tiroglobulina marcador de tumor debe desaparecer tras tiroidectomia. Con la tiroidectomia total si aparecen niveles de tiroglobulina nos podria servir como marcador de tumor.
Linfadenectomia: no se realiza de manera profiláctica, vaciamiento ganglionar en presencia de afectación, se realiza mediante biopsia intraoperatoria.
Sistemáticamente en el papilar, haremos un vaciamiento de los ganglios que hay debajo del itsmo, si vemos que hay afectación de los ganglios, haremos una linfadenectomia del lado homolateral completa. En el folicular no es un acto sistematico a no ser que haya afectación.
FACTORES DE RIESGO DE MALIGNIDAD DE NODULOS:
– Nódulo solitario, duro, fijo. ( folicular, anaplásico, carcinoma medular, o anaplásico)
– Crecimiento rápido ( medular o anaplásico, mas malignos)
– Alteraciones de la voz ( infiltración del recurrente, algo crece deprisa)
– Presencia de linfadenopatías
– No disminuye con el tratamiento ( distiroidectomias, suelen tener buena respuesta al
tratamiento) ( ejemplo, bocio que no responde a tratamiento, puede ser que se a
autónomo o que sea un tumor)
– Gammagraficamente frio ( mayor indicación de malignidad, los calientes raramente
son malignos)
– Paciente joven ( mas tendencia a que sea un carcinoma)
– Nódulo solido en la ecografía ( más frecuente que liquido de ser maligno)
– Historia de: radiación (riesgo de carcinoma mayor), o de neoplasia tiroidea familiar,
neoplasia pluriendocrina familiar.
Eco-PAAF:
La usamos para tomar una decisión quirúrgica, hay casos que no tenemos tan claro que
realizar tras el resultado de la PAAF. Las lesiones quísticas más frecuentemente son benignas, pero podemos tener un falso negativo. PAAF que nos da benignidad y no cumple criterios de sospecha de neoplasia adoptaremos una actitud conservadora.
Lesión sólida y la PAAF dice que es maligna, opera. Otras posibilidad es que la PAAF no este clara, diga que es una proliferación altamente celular, si a esto añadimos criterios de malignidad por parte del enfermo, en estos casos plantearemos una indicación quirúrgica, al igual que con los de las células de Hürtle que pueden ser malignos.
- Anaplasico: indicación de tiroidectomía total
– Tumor operable tiroidectomía total: resección de las cadenas ganglionares, irradiación
externa postoperatoria con alta dosis: electroterapia de alto voltaje 4555 a 5000 rad, disminuye las recidivas totales
– Tumor irresecable: irradiación paliativa
– Metástasis: I131 , raro porque los anaplásicos no suelen ser funcionantes ( los que mejor
captan el yodo a nivel de las metástasis son los foliculares)
Indicaciones de yodoterapia o tiroidectomía isotópica:
– Disminuir el número de indicaciones quirúrgicas.
– Se consideraba antiguamente que la morbimortalidad de la cirugía era muy alta, por lo
que esta técnica se usaba mucho.
– Las indicaciones actuales han disminuido: podría elevar la incidencia de leucemias y
neoplasias a largo plazo, sobretodo en individuos jóvenes, además las técnicas quirúrgicas han mejorado
– Indicaciones: Riesgo anestésico, Recidiva pequeña, donde las reintervenciones aumentan la morbilidad recurrencial y tiroidea mayor. ( en pacientes sometidos a tiroidectomia parcial), Carcinomas papilares o foliculares con afectación ganglionar.
Carcinoma medular: Es tan diferente en su celularidad y comportamiento que debemos de estudiarlo de manera separada. 1958 Hazard, Crile: descripción del Ca medular. Clínica y histologíacamente diferente del anaplasico 1961 Sippele: observa un aumento de la incidencia del cáncer de tiroides, en pacientes con feocromocitomas 1962 Copp: calcitonina ( polipeptido hipocalcemiante) hallazgo de la misma en la tiroides.
Carcinoma medular derivado de las células C productoras de calcitonina, tienen una actividad secretora muy intensa, no solo va a segregar calcitonina.
Se asocia a otros trastornos endocrinos y puede ser:
– Esporádico: 85-90% de los casos, bilateral 15%
– Familiar 10-15% de los casos ( hasta 25%), gen autosómico dominante ( penetración variable), bilateral en el 80% de los familiares. Contexto de neoplasia endocrina multiple
ETIOPATOGENIA:
Se ha encontrado una mutacion en el ADN de las células tumorales del CMT, relaciones con el protooncogen RET. ( CR10). Se expresaría una enzima mutada de las tirosincinasas RET. Esta implicada en la regulación del crecimiento y diferenciación celular de todos los CMT. En un paciente con un posible carcinoma medular, determinamos el gen en el enfermo y si esto es +, haremos las determinaciones en toda la familiar. El tumor produce calcitonina y CEA, pero se sospecha que puede haber tumores incipientes que no dan elevación de calcitonina, por lo que esta es fundamental en el enfermo que
sabemos que esta afectado, porque nos sirve de marcador de tumor y de ver si hemos extirpado el tumor y sus metástasis o recidivas si la monitorizamos en el tiempo. En la familia podemos hacer determinaciones de calcitonina, pero con una enfermedad incipiente podemos no encontrar valores alterados, ademas este seguimiento es costoso, por lo que haremos la determinación del gen RET si el paciente enfermo tiene la mutacion y esto nos a va llevar a que todos los familiares con la alteración del gen RET, deben de ser sometidos a una TIROIDECTOMIA PROFILACTICA. La herencia de esta mutacion es autosómica dominante.
ANATOMIA PATOLOGICA: Crecimiento nodular muy duro, constituido por células parafoliculares con grandes núcleos hipercromicos.
ACTIVIDAD SECRETORA:
– Calcitonina: tets diagnostico en familiares, seguimiento postoperatorio, detectar
metástasis.
– Histaminasa
– Pgs
– Serotonina
– Dopa descarboxilasa
– Beta endorfina
– Factor de crecimiento nerviosos
– Somatostatina
– ACTH y CRH
SINTOMATOLOGIA Y DIAGNOSTICO:
Sospecha diagnostica en pacientes con patología tiroidea asociada a hipocalcemia, la patología del tiroides benigna o maligna no suele alterar la calcemia, pero si tenemos alteración de esta debemos de sospechar un aumento de actividad de la calcitonina.
Igual en ambos sexos. Aparición de un bocio duro ( nódulo)
Datos obligados de anamnesis: sudoración, cefalea, diarrea ( 30%), enrojecimiento, antecedentes familiares, HTA,.. debido al resto de hormonas que produce. Esta sintomatología no se parece a la de un enfermos con un hipo/hipertiroidismo. ( no hay tanto temblor ni sudor de las manos ni alteración ocular como habría por ejemplo en un basedow)
DIAGNOSTICO:
– Estudio funcional tiroideo: normal
– Pruebas de estimulo y creación: norma
– Gammagrafía tiroidea: nódulo frio
– Eco: nódulo solido
– Rx cervical: calcificaiaciones en la región tiroidea, estas pueden ser tan importantes
que se ven en una simple Rx
– Hecho patognomónico. Elevación de calcitonina mayor de 0.2 ng/ml
– Aumento de CEA
– Aumento de histaminasa en sangre
– Es obligado buscar la enfermedad pluriendocrina: estudio de suprarrenal (
feocromocitoma), buscar alteraciones de la paratohormona, Rm abd para ver
alteraciones pancreáticas…
ESTADIAJE
Buscamos la región cervical, lesiones en toras, lesiones hepáticas u óseas. Hacemos un estudio de la familia sobretodo en el medular bilateral ( pero en principio siempre)
Determinación gen RET al enfermo.
TRATAMIENTO:
Evolucion natural es peor que el papilar o folicular ( mejor que anaplasico)
Es quirúrgico siempre, son células que no captan yodo.
Empeoran el pronóstico:
– Edad, peor 30-40 años
– Invasión ganglionar
– Tiempo de evolución: desarrollo metacrónico de otros tumores
– Cáncer familiar de la enfermedad
– Actuitud agresiva y radical de la tiroides, vaciamiento del compartimiento centra mas linfadenectomia homolateral o incluso contralateral ( esta ultima en un segundo tiempo), por tanto actitud agresiva. A veces incluimos ganglio mediastínicos porque es un tumor que responde mal a la quimioterapia y a la radioterapia.
Debemos de hacer un seguimiento:
– CEA y calcitonina, estos aumentan con recidivas locales, metástasis
– Estudio suprarrenal y paratiroideo ( PTH)
 los objetivos generales, un mal clima destruye el ambiente de trabajo ocasionando situaciones de conflicto, malestar y generando un bajo rendimiento.
los objetivos generales, un mal clima destruye el ambiente de trabajo ocasionando situaciones de conflicto, malestar y generando un bajo rendimiento.


 habitual en la parte anterior baja del cuello, lo que da por resultado falta de glándula tiroides o glándula tiroides ectópica que funciona mal. La transferencia placentaria hacia el embrión de anticuerpos bloqueadores contra receptor de TSH desde una madre con tiroiditis de Hashimoto puede dar por resultado agenesia de la glándula tiroides y cretinismo atirótico, pero por lo general sólo causa hipotiroidismo transitorio. Los defectos hereditarios de la biosíntesis de hormona tiroidea también pueden causar hipotiroidismo y bocio neonatales. Otras causas posibles de hipotiroidismo neonatal son exposición a yoduros durante el embarazo, administración de fármacos antitiroideos a la madre, o administración inadvertida de yodo radiactivo para tirotoxicosis o cáncer tiroideo.
habitual en la parte anterior baja del cuello, lo que da por resultado falta de glándula tiroides o glándula tiroides ectópica que funciona mal. La transferencia placentaria hacia el embrión de anticuerpos bloqueadores contra receptor de TSH desde una madre con tiroiditis de Hashimoto puede dar por resultado agenesia de la glándula tiroides y cretinismo atirótico, pero por lo general sólo causa hipotiroidismo transitorio. Los defectos hereditarios de la biosíntesis de hormona tiroidea también pueden causar hipotiroidismo y bocio neonatales. Otras causas posibles de hipotiroidismo neonatal son exposición a yoduros durante el embarazo, administración de fármacos antitiroideos a la madre, o administración inadvertida de yodo radiactivo para tirotoxicosis o cáncer tiroideo.


 presencia de algunas enfermedades como anemia aplásica, neutropenia, inmunodeficiencias, diabetes o a condiciones como alcoholismo, desnutrición y trasplante de órganos. Los agentes causantes incluyen bacterias aerobias y anaerobias, incluyendo estreptococos y estafilococos, los cuales producen una importante necrosis
presencia de algunas enfermedades como anemia aplásica, neutropenia, inmunodeficiencias, diabetes o a condiciones como alcoholismo, desnutrición y trasplante de órganos. Los agentes causantes incluyen bacterias aerobias y anaerobias, incluyendo estreptococos y estafilococos, los cuales producen una importante necrosis






 gastrointestinal del yodo o bien en su utilización por la glándula denominadas bociógenos. Para evitar el déficit de yodo se ha añadido yoduro sódico a la sal común. Los yoduros ingeridos por vía oral se absorben desde el tubo digestivo hasta la sangre. La mayoría se excreta vía renal, pero, en condiciones normales, 1/5 parte es retirada por las células tiroideas para la síntesis de hormonas tiroideas. Para medir el déficit de yodo se puede medir la excreción urinaria del mismo, así, a menor excreción, mayor déficit. Por otra parte, y en sentido inverso, también las hormonas tiroideas son metabolizadas hasta yoduros en diversos tejidos diana de las mismas. Este yoduro pasa a sangre y de nuevo es captado por la glándula tiroides o excretado por orina. Existe una pequeña cantidad de yodo (unos 10-20mg) que se pierde por las heces. Cuando la ingesta de yodo es inferior a los requerimientos aumenta la proporción que es captada y utilizada en la tiroides frente a la que se elimina por la orina. Cuando la ingesta es superior a los requerimientos se elimina una proporción mayor por la orina.
gastrointestinal del yodo o bien en su utilización por la glándula denominadas bociógenos. Para evitar el déficit de yodo se ha añadido yoduro sódico a la sal común. Los yoduros ingeridos por vía oral se absorben desde el tubo digestivo hasta la sangre. La mayoría se excreta vía renal, pero, en condiciones normales, 1/5 parte es retirada por las células tiroideas para la síntesis de hormonas tiroideas. Para medir el déficit de yodo se puede medir la excreción urinaria del mismo, así, a menor excreción, mayor déficit. Por otra parte, y en sentido inverso, también las hormonas tiroideas son metabolizadas hasta yoduros en diversos tejidos diana de las mismas. Este yoduro pasa a sangre y de nuevo es captado por la glándula tiroides o excretado por orina. Existe una pequeña cantidad de yodo (unos 10-20mg) que se pierde por las heces. Cuando la ingesta de yodo es inferior a los requerimientos aumenta la proporción que es captada y utilizada en la tiroides frente a la que se elimina por la orina. Cuando la ingesta es superior a los requerimientos se elimina una proporción mayor por la orina. mayoritariamente en el lumen de los folículos tiroideos. El retículo endoplasmático y el aparato de Golgi son los encargados de sintetizar y glicosilar la TG y secretarla hacia los folículos. Las moléculas de TG glicosilada se empaquetan en vesículas exocitócicas, saliendo así del aparato de Golgi al citoplasma celular. Estas vesículas se funden en la membrana apical que bordea el lumen folicular, liberando su contenido al mismo. Tanto la síntesis de TG como su exocitosis al lumen están bajo el control de la TSH.
mayoritariamente en el lumen de los folículos tiroideos. El retículo endoplasmático y el aparato de Golgi son los encargados de sintetizar y glicosilar la TG y secretarla hacia los folículos. Las moléculas de TG glicosilada se empaquetan en vesículas exocitócicas, saliendo así del aparato de Golgi al citoplasma celular. Estas vesículas se funden en la membrana apical que bordea el lumen folicular, liberando su contenido al mismo. Tanto la síntesis de TG como su exocitosis al lumen están bajo el control de la TSH. lipoproteínas. Aproximadamente el 0.02 % está libre en suero.
lipoproteínas. Aproximadamente el 0.02 % está libre en suero.